


肺动脉高压(Pulmonary arterial hypertension, PAH)是一种进行性疾病,其病理特征为肺微血管增厚、变窄,导致肺血管阻力升高,右心室肥厚,最终导致右心室衰竭和死亡。1951年,美国科学家David Dresdale首次发现了肺动脉高压,1954年他提出肺动脉高压是一个遗传因素起重要作用的疾病。1984年,肺动脉高压被确定为单基因常染色体显性遗传病。1997年肺动脉高压的遗传学研究有了较大的进步:科学家发现肺动脉高压的致病基因位于二号染色体的长臂的31到32的区间。在此基础上,2000年科学家克隆出了第一个肺动脉高压的致病基因——BMPR-Ⅱ,BMPR-Ⅱ是到目前为止已知的最主要肺动脉高压的致病基因。
同时PAH病理生理过程复杂,可能与遗传多态性、多基因缺陷、其他的分子以及环境因素有关。据以往的报道,转化生长因子β(TFG-β)超家族信号传导系统异常被认为是PAH重要的发病病因。骨形成蛋白BMPR-Ⅱ受体(BMPR2)基因突变是TFG-β超家族中可能导致PAH的主要原因。目前约发现390个位于BMPR2基因上的不同突变位点。在以往针对BMPR2的研究主要集中在其在肺血管重塑过程中的作用,而伴有BMPR2突变的PAH患者最终的心力衰竭是否与原发性心肌细胞异常有关尚未阐明。
近日发表在《European Respiratory Journal》IF= 16.671中文章——Single-cell RNA sequencing reveals that BMPR2 mutation regulates right ventricular function via ID genes,研究人员通过利用患者来源的的诱导多能干细胞和小鼠模型揭示了由BMPR2突变后是如何促进冠心病患者PAH的发展。

结果一:为了研究BMPR2突变在冠心病-肺动脉高压背景下对心肌细胞(CMs)的影响,研究人员首先从具有BMP受体(BMPR)突变的冠心病-肺动脉高压患者 (CHD-PAH mut iPSCs),无BMPR突变(CHD-PAH w/o iPSCs)的患者和健康供者(Control iPSCs) 分别产生iPSCs,并分化为有节奏收缩的CMs。三组分化后的细胞均表达了CMs特异性Marker基因。但在分化过程中CHD-PAH iPSC组中cTnT、GATA4、TBX5等Marker 基因的表达量明显降低。同时研究人员还发现CHD-PAH iPSC组中心肌细胞分化效率明显低于对照组和无BMPR突变组。在对分化后的CMs的功能研究中,与对照和无BMPR突变组相比,CHD-PAH诱导的CMs的Ca2+瞬态振幅和半衰减时间显著降低。这些结果表明,BMPR2突变影响了CHD-PAH iPSC-CMs的分化和Ca2+处理。同时CHD-PAH突变iPSC的下游BMPR2/ID信号通路基因中ID1和ID3的表达水平低于对照iPSC系。
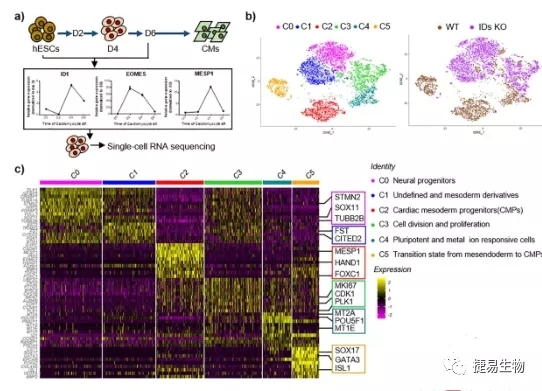
结果二:在进一步的机制研究中,研究人员利用在ID1和ID3共敲除的胚胎干细胞(HESC)和单细胞测序技术,不仅验证了DNA结合抑制蛋白(IDs)对心肌分化的重要影响,同时scRNA-seq分析揭示ID1和ID3主要通过驱动中胚层调控iPSC向心肌细胞分化。scRNA-seq技术可以根据混合细胞的基因表达对其进行有利的分类,并识别新的细胞类型或标记基因。在本研究中,共发现了6个主要的细胞簇C0-C5,表达心肌中胚层祖细胞(CMP)相关基因的簇2和簇5是IDs KO细胞中受影响的主要群体。DEG分析显示,与WT细胞相比,大多数IDs KO细胞簇中USP9X表达减少。
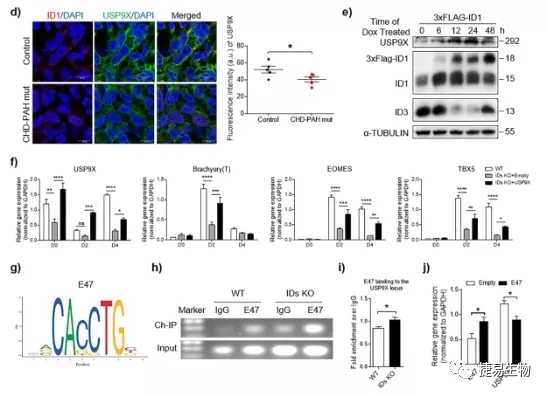
接下来研究人员检测了BMPR2突变后是如何通过USP9X对CHD-PAH诱导多能干细胞CMs分化造成影响。这其中发现了能都与USP9X结合形成异二聚体的E蛋白转录因子- E47。通过序列分析发现USP9X启动子区域包含有E47结合位点序列。ChIP-PCR检测显示,E47与USP9X启动子的结合在IDs KO细胞中增加。此外,过表达E47后可以检测到USP9X水平降低,这说明E47对USP9X基因转录有抑制作用。
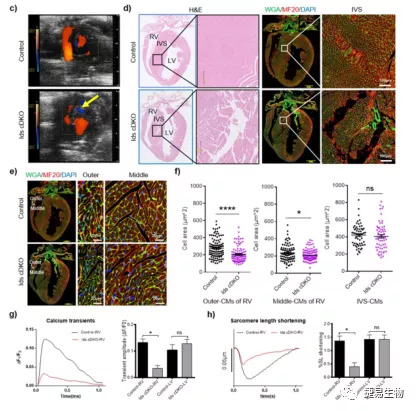
结果三:在BMPR2+/-小鼠右心室组织中BMPR2蛋白表达降低50%,同时下游的pSmad1/5和ID1/ID3蛋白水平显著降低。这些结果表明,由突变后造成BMPR2表达量的减少,进而造成了ID1和ID3蛋白量的减少。另外本研究中还应用了ID1/3条件敲除的小鼠模型,避免了双敲除造成小鼠胚胎致死。ID1/3敲除的小鼠存在明显的心脏缺损并伴随自发性的PAH (SPAH)、肺动脉壁明显增厚。
研究结果表明,突变的BMPR2通过IDs信号通路导致E47在USP9X启动子上积累,在心肌细胞分化过程中负调控USP9X基因表达。