


胰岛素的作用是调节机体代谢,维持血糖平衡。在正常的胰岛细胞中,一般30~50min就可以合成成熟且具有活性的胰岛素。胰岛素的分泌过程经过转录,翻译、胰岛素原转入高尔基体加工后成为成熟胰岛素,储存在胰岛素分泌颗粒中,遇刺激后释放。
新生儿糖尿病(Neonatal diabetes mellitus, NDM )是指出生6个月内出现的一种罕见的单基因糖尿病。诊断需要高血糖持续2周以上,且需要胰岛素治疗,同时排除感染、应激、药物等引起的高血糖。NDM据转归分为暂时性新生儿糖尿病(TNDM)和永久性新生儿糖尿病(PNDM),约各占50%。目前NDM涉及的基因有20余种,其中INS基因突变占15%左右。INS编码前胰岛素原,其显性突变可引起PNDM、青少年发病的成人型糖尿病(MODY)和自身抗体阴性的Ⅰ型糖尿病(TⅠDM)。以往的研究报道中,INS显性突变引起胰岛素原错误折叠,其聚集在内质网,引起内质网应激,但其导致β细胞损伤的机制仍不清楚。如:在β细胞发育过程中,突变的胰岛素细胞和内质网应激引起的哪些分子的变化以及对β细胞功能的影响有哪些?携带INS杂合变异的β细胞能否正常产生和分泌成熟的胰岛素?
为了研究这些问题,研究人员利用携带INS突变的糖尿病患者的皮肤成纤维细胞在体外诱导生成多能干细胞,利用干细胞的多向分化潜能使其定向分化为胰腺β样细胞用于研究和解释这些问题(PMID: 34448879)。
在iPSC分化后胰腺β样细胞中,分化第35D,在携带INS基因C109Y杂合突变细胞中PDX1阳性细胞数量明显低于野生型iPSC分化后胰腺β样细胞,PDX1作为β细胞的Marker基因,在调解胰腺发育、分化以及胰岛素分泌中起着重要作用。通过单细胞测序技术(scRNA-seq)显示与细胞增殖、凋亡和炎症相关信号通路在两组细胞间存在显著差异。通过在小鼠胰岛素瘤细胞(MIN6细胞系)中实验证实INS基因突变会导致胰岛素原错误折叠、加工及运输紊乱,进而造成内质网应激增加,胰岛素分泌缺陷。
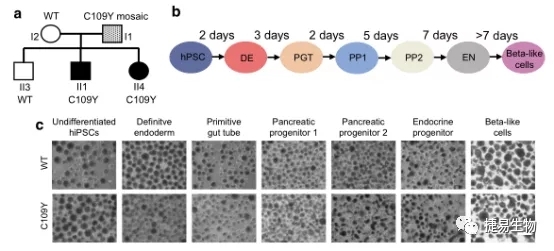
hiPSC除了可以帮助阐明糖尿病的潜在分子机制外,在糖尿病治疗方面也大有可为。与体内大多数细胞不同,干细胞具有自我更新的能力,可以分化为多种细胞类型,因此,干细胞有可能被用于替代糖尿病患者体内已经死亡的胰腺β细胞,从而恢复这些患者的胰岛素产生和葡萄糖调解能力。同时诱导多能干细胞可以从糖尿病患者的血细胞和成纤维细胞经过重编程获得,并通过基因编辑校正与糖尿病相关的突变和基因变异,通过这样的方式允许几乎无限量的供应胰岛β细胞用于细胞替代疗法,同时由于是将自身的细胞移植患者体内,移植排斥的可能性较小。但在实际操作中,分化后β细胞的质量、纯度及其临床安全性,都是在迈向Ⅰ型糖尿病患者β细胞替代疗法转化中需要解决的问题。

今年3月,美国制药巨头Vertex宣布,该公司用于治疗Ⅰ型糖尿病产品VX-880已获得了美国食品和药品管理局(FDA)的快速通道资格认定。VX-880是第一个利用完全分化的、产生胰岛素的胰岛细胞治疗Ⅰ型糖尿病的干细胞衍生疗法,用于替代Ⅰ型糖尿病患者中被破坏的胰岛细胞,从而取代胰岛素注射的治疗和长期护理。近日,Vertex公司刚刚公布了第一位参加 I/II期试验的1型糖尿病患者的数据,在接受目标剂量一半的VX-880单次输注并结合免疫抑制治疗后,VX-880恢复了患者的胰岛素产生,第90 天治疗后,患者每日外源性胰岛素使用量减少了91%。这无疑是令人振奋的消息,虽然目前只有1例患者的成功案例,但是这足以说明干细胞疗法的可行性,同时这些结果也支持该疗法的临床试验的继续进行。
参考资料:
[1]巩纯秀, 曹冰燕. 新生儿糖尿病分子遗传学机制研究进展[J]. 中华实用儿科临床杂志, 2015, 000(020):1521-1524.
[2] Amirruddin N S , Tan W X , Tan Y S , et al. Progressive endoplasmic reticulum stress over time due to human insulin gene mutation contributes to pancreatic beta cell dysfunction[J]. 2021
[3]https://news.vrtx.com/press-release/vertex-announces-positive-day-90-data-first-patient-phase-12-clinical-trial-dosed-vx